Apa itu Sistem Periodik Unsur ?
- Sistem periodik adalah suatu tabel berisi identitas unsur-unsur yang dikemas secara berkala dalam bentuk periode dan golongan berdasarkan kemiripan sifat-sifat unsurnya.
- Tabel Berkala adalah Penataan secara tabel dari unsur-unsur berdasarkan hukum berkala
- Periode adalah : lajur-lajur horizontal dalam sistem periodik
- Golongan adalah : kolom-kolom vertikal dalam sistem periodik
Baca Juga Artikel Yang Mungkin Berhubungan : Makalah Teori Indikator Asam Basa : Indikator, Ciri, Contoh Dan Fungsinya
Pengelompokan Unsur Unsur berdasarkan sifat kelogamannya
Unsur Logam
- Kerapatannya tinggi
- Padat (dapat ditempa/dibentuk)
- Bersifat konduktor
- Mengkilap
Unsur Non Logam
- Kerapatannya rendah
- Rapuh
- Bersifat isolator
- Tidak Mengkilap
Unsur kimia, adalah zat kimia yang tidak dapat dibagi lagi menjadi zat yang lebih kecil, atau tidak dapat diubah menjadi zat kimia lain dengan menggunakan metode kimia biasa.
Partikel terkecil dari unsure (Unsur Kimia) adalah atom. Sebuah atom terdiri atas inti atom (nukleus) dan dikelilingi oleh elektron. Inti atom terdiri atas sejumlah proton dan neutron. Hingga saat ini diketahui terdapat kurang lebih 117 unsur di dunia.
Baca Juga Artikel Yang Mungkin Berhubungan : Larutan Elektrolit : Pengertian, Ciri, Dan Jenis Beserta Contohnya Secara Lengkap
Gambar Tabel Periodik Unsur Kimia
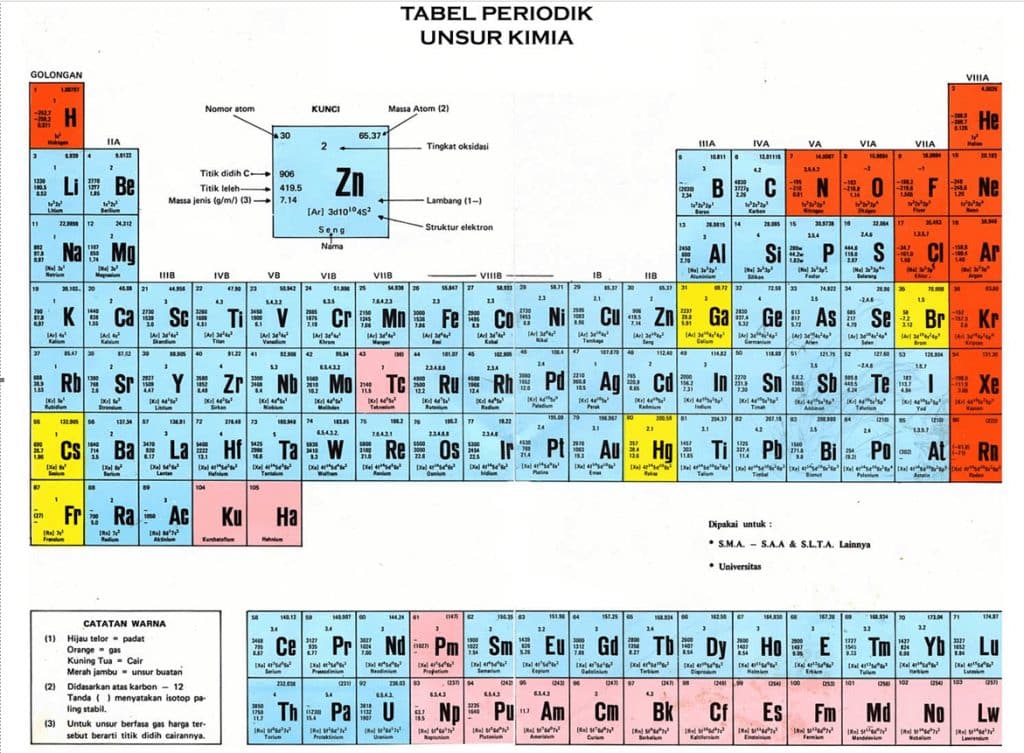
Penjelasan Tabel Periodik Unsur Kimia
Hal yang membedakan unsur satu dengan lainnya adalah “jumlah proton” dan jumah elektron suatu unsur atau ikatan dalam inti atom tersebut. Misalnya, seluruh atom karbon memiliki proton sebanyak 6 buah, sedangkan atom oksigen memiliki proton sebanyak 8 buah. Jumlah proton pada sebuah atom dikenal dengan istilah nomor atom (dilambangkan dengan Z).
Namun demikian, atom-atom pada unsur yang sama tersebut dapat memiliki jumlah netron yang berbeda; hal ini dikenal dengan sebutanisotop. Massa atom sebuah unsur (dilambangkan dengan “A”) adalah massa rata-rata atom suatu unsur pada alam.
Baca Juga Artikel Yang Mungkin Berhubungan : Campuran : Pengertian, Ciri, Dan Macam Serta Contohnya Dalam Ilmu Kimia
Karena massa elektron sangatlah kecil, dan massa neutron hampir sama dengan massa proton, maka massa atom biasanya dinyatakan dengan jumlah proton dan neutron pada inti atom, pada isotop yang memiliki kelimpahan terbanyak di alam. Ukuran massa atom adalah satuan massa atom (smu). Beberapa isotop bersifat radioaktif, dan mengalami penguraian (peluruhan) terhadap radiasi partikel alfa atau beta.
Lambang kimia Tabel Sistem Periodik Unsur Kimia
Sebelum kimia menjadi bidang ilmu, ahli alkemi telah menentukan simbol-simbol baik untuk logam maupun senyawa umum lainnya. Mereka menggunakan singkatan dalam diagram atau prosedur; dan tanpa konsep mengenai suatu atom bergabung untuk membentuk molekul. Dengan perkembangan teori zat, John Dalton memperkenalkan simbol-simbol yang lebih sederhana, didasarkan oleh lingkaran, yang digunakan untuk menggambarkan molekul.
Sistem yang saat ini digunakan diperkenalkan oleh Berzelius. Dalam sistem tipografi tersebut, simbol kimia yang digunakan adalah singkatan dari nama Latin (karena waktu itu Bahasa Latin merupakan bahasa sains); misalnya Fe adalah simbol untuk unsur ferrum (besi),Cu adalah simbol untuk unsur Cuprum (tembaga), Hg adalah simbol untuk unsur hydrargyrum (air raksa), dan sebagainya.
Baca Juga Artikel Yang Mungkin Berhubungan : Larutan Asam : Pengertian, Ciri, Dan Sifat Beserta Contohnya Secara Lengkap
Simbol kimia digunakan secara internasional, meski nama-nama unsur diterjemahkan antarbahasa. Huruf pertama simbol kimia ditulis dalam huruf kapital, sedangkan huruf selanjutnya (jika ada) ditulis dalam huruf kecil.
Tata nama
Penamaan unsur telah jauh sebelum adanya teori atom suatu zat, meski pada waktu itu belum diketahui mana yang merupakan unsur, dan mana yang merupakan senyawa. Ketika teori atom berkembang, nama-nama unsur yang telah digunakan pada masa lampau tetap dipakai. Misalnya, unsur “cuprum” dalam Bahasa Inggris dikenal dengan copper, dan dalam Bahasa Indonesia dikenal dengan istilah tembaga. Contoh lain, dalam Bahasa Jerman “Wasserstoff” berarti “hidrogen”, dan “Sauerstoff” berarti “oksigen”.
Nama resmi dari unsur kimia ditentukan oleh organisasi IUPAC. Menurut IUPAC, nama unsur tidak diawali dengan huruf kapital, kecuali berada di awal kalimat. Dalam paruh akhir abad ke-20, banyak laboratorium mampu menciptakan unsur baru yang memiliki tingkat peluruhan cukup tinggi untuk dijual atau disimpan.
Baca Juga Artikel Yang Mungkin Berhubungan : Termokimia : Pengertian, Sistem, Reaksi, Dan Rumus Serta Contohnya Lengkap
Nama-nama unsur baru ini ditetapkan pula oleh IUPAC, dan umumnya mengadopsi nama yang dipilih oleh penemu unsur tersebut. Hal ini dapat menimbulkan kontroversi grup riset mana yang asli menemukan unsur tersebut, dan penundaan penamaan unsur dalam waktu yang lama.
SEJARAH PERKEMBANGAN SISTEM PERIODIK UNSUR
Sistem periodik yang ada sekarang ini merupakan hasil dari perkembangan pengelompokkan unsur yang dilakukan oleh para ahli sebelumnya.
Pengelompokan Unsur Menurut Para Ahli
Awal Mula Perkembangan Pengelompokkan Unsur
Ahli Kimia dari Arab dan Persia
Para ahli kimia dari Arab dan Persia awalnya mengelompokkan zat-zat berdasarkan sifat logam dan non logam.
A. Antoine Lavoisier (1789)
Pada 1789, Lavoisier mengelompokkan 33 unsur kimia.
- GAS
Cahaya,Kalor,Oksigen,Nitrogen,Hidrogen
- TANAH
Kapur,Magnesium Oksida, Barium Oksida, Aluminium Oksida, Silikon Oksida
- LOGAM
Antimon, Perak, Arsenik, Bismuth, Kobalt, Tembaga, Timah, Besi, Mangan, Raksa, Molibdenum, Nikel, Emas, Platina,Timbel,Tungsten, Seng
- NON LOGAM
Sulfur, Fosfor, Karbon, Asam Klorida, Asam Fluorida, Asam Borak
Baca Juga Artikel Yang Mungkin Berhubungan : Larutan Basa : Pengertian, Ciri, Dan Sifat Beserta Contohnya Secara Lengkap
Kelemahan dan Kelebihan Teori Lavoisier
- Kelemahan : pengelompokan masih terlalu umum, ada senyawa dan zat lain yang bukan merupakan unsur.
- Kelebihan : sudah mengelompokkan 33 unsur yang ada berdasarkan sifat kimia sehingga bisa dijadikan referensi bagi ilmuwan-ilmuwan setelahnya.
- B. John Dalton (1808)
Dalton mengemukakan bahwa unsur dari atom yang berbeda mempunyai sifat dan massa yang berbeda. Massa atom diperoleh dari perbandingan massa atom unsur terhadap massa atom unsur hidrogen. Berangkat dari teorinya itu Dalton mengelompokkan zat-zat yang berupa unsur-unsur (sebanyak 36 unsur) berdasarkan kenaikan massa atomnya.
Daftar Unsur yang disusun oleh Dalton:

- C. John Jacobs Berzellius (1828)
Dalam daftar massa unsur yang dibuat oleh Dalton terdapat kesalahan dalam penentuan massa atom unsur. Pada tahun 1828 Barzellius berhasil membuat dan mempublikasikan daftar massa atom unsur-unsur yang lebih akurat.
- D. Johann Dobereiner (1829)
*Ilmuwan pertama yang mengembangkan sistem periodik unsur (tahun 1817)
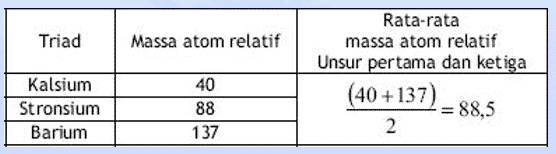
Pada tahun 1829, Johann Wolfgang Dobereiner, seorang ilmuwan Jerman, adalah yang pertama untuk mengklasifikasikan unsur-unsur ke dalam kelompok berdasarkan pernyataan John Dalton yaitu berdasarkan massa atomnya.
Dari hasil penelitiannya, diperoleh bahwa massa atom Stronsium hampir = massa atom rata-rata dua unsur lain yg mirip dengan Stronsium yaitu Kalsium dan Barium.
- Dobereiner membuat kelompok-kelompok unsur yang masing-masing kelompok terdiri atas tiga unsur yang disebut triade.
- Dalam satu triade, massa atom unsur yang terletak di tengah merupakan harga rata-rata massa atom pertama dan ketiga.
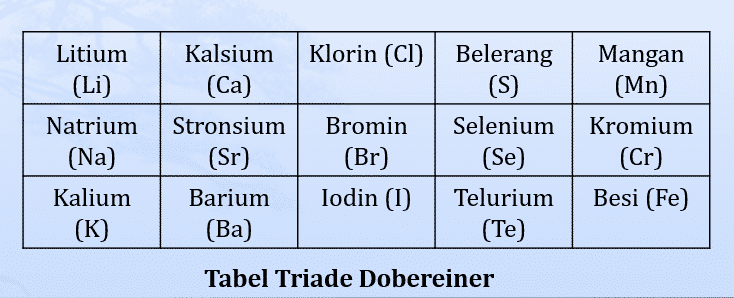
Kelemahan dan Kelebihan Triade Dobereiner
Kelemahan :
- Pengelompokan unsur ini kurang efisien dengan adanya beberapa unsur lain dan tidak termasuk dalam kelompok triade padahal sifatnya sama dengan unsur dalam kelompok triade tersebut.
- Sejumlah besar elemen yang sama tidak dapat dikelompokkan ke dalam triade misalnya, besi, mangan, nikel, kobalt, seng dan tembaga adalah elemen yang serupa tapi tidak bisa ditempatkan di triade.
- Memungkinkan unsur-unsur cukup berbeda dapat dikelompokkan ke dalam triade.
Kelebihan : adanya keteraturan setiap unsur yang sifatnya mirip; massa atom unsur yang kedua (tengah) merupakan massa atom rata-rata di massa atom unsur pertama dan ketiga.
E. John Alexander Reina Newlands (1865)
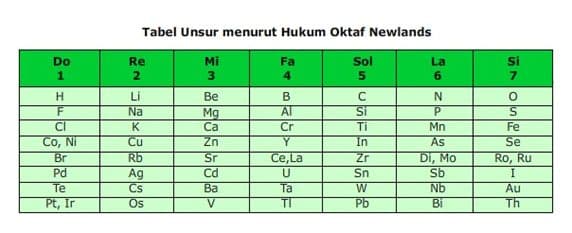
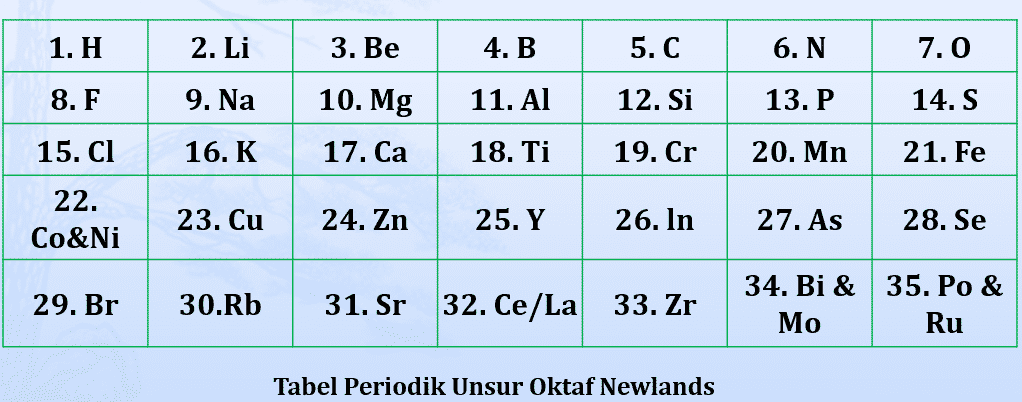
Pada tahun 1865, mengelompokkan unsur-unsur berdasarkan kenaikan massa atom. Ia mengamati setiap pengulangan delapan unsur akan terdapat kemiripan sifat. Dengan demikian berarti unsur kesatu mirip unsur kedelapan, unsur kedua mirip unsur kesembilan demikian seterusnya. Newlands menyebut pengulangan ini sebagai hukum oktaf.
Disebut hukum Oktaf karena beliau mendapati bahwa sifat-sifat yang sama berulang pada setiap unsur ke delapan dalam susunan selanjutnya dan pola ini menyerupai oktaf dalam tangga nada musik.
- Newlands menyatakan bahwa sifat-sifat unsur berubah secara teratur. Unsur pertama mirip dengan unsur kedelapan, unsur kedua mirip dengan unsur kesembilan, dan seterusnya.
Kelemahan dan Kelebihan Hukum Oktaf Newlands
Kelemahan dari teori ini adalah :
- Dalam kenyataannya masih ditemukan beberapa oktaf yang isinya lebih dari delapan unsur.
- Penggolongannya tidak cocok untuk unsur yang massa atomnya sangat besar.
- Hukum Oktaf Newlands ternyata hanya berlaku untuk unsur-unsur ringan.
- Jika diteruskan, teryata kemiripan sifat terlalu dipaksakan.
Kelebihan dari teori ini adalah unsur yang disusun ke dalam tabel periodik semakin banyak (kurang lebih sekitar 63 jenis unsur).
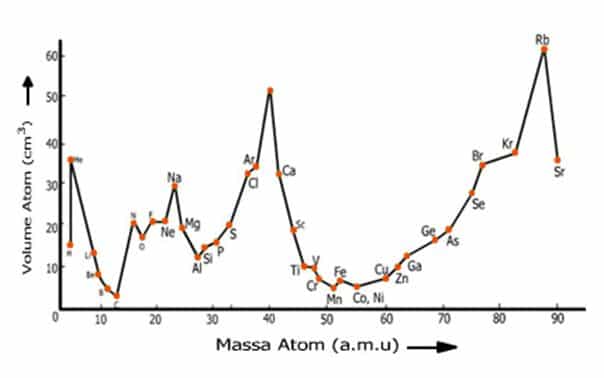
f.Lothar Meyer (1869)
Pada tahun 1969, Lothar Meyer mengamati hubungan antara kenaikan massa atom dengan sifat unsur. Hal ini dilakukan antara lain dengan membuat Kurva volume atom versus fungsi massa atom.
Dari kurva, ia mengamati adanya keteraturan dari unsur-unsur dengan sifat yang mirip, dan pengulangan sifat unsur tidak selalu setelah 8 unsur, seperti dinyatakan dalam hukum oktaf.
Gambar Sistem periodik Meyer. Unsur-unsur disusun berdasarkan kenaikan massa atom secara vertikal. Pengulangan sifat unsur membentuk kolom. Sedangkan unsur-unsur dengan sifat yang mirip terletak pada baris yang sama.
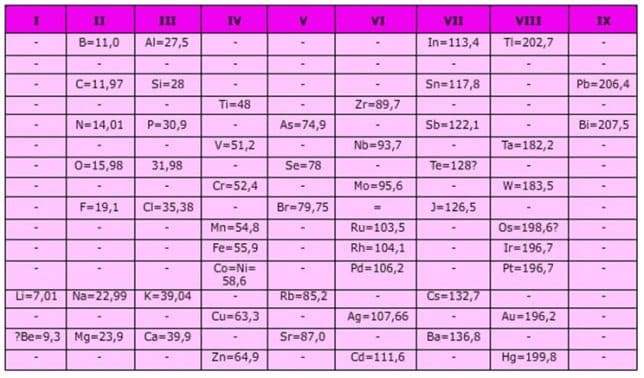
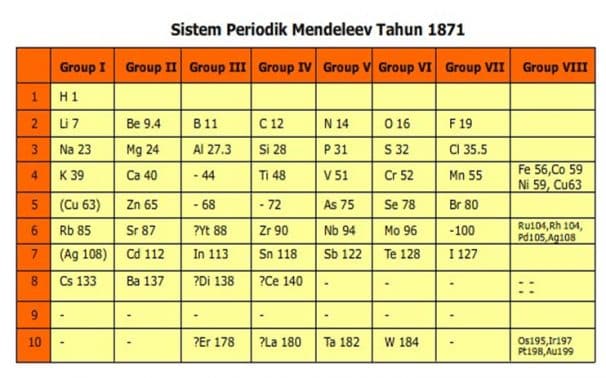
G. Dmitri Ivanovich Mendeleev (1869)
Pada tahun 1869 Mendeleev membuat sistem periodik berdasarkan kenaikan massa atom dan kemiripan sifat. Unsur-unsur dengan sifat yang mirip ditempatkan pada kolom yang disebut golongan. Sedangkan pengulangan sifat menghasilkan baris yang disebut periode.
- Sistem periodik Mendeleev selain disusun berdasarkan kenaikan massa atom, juga ditentukan berdasarkan kemiripan.
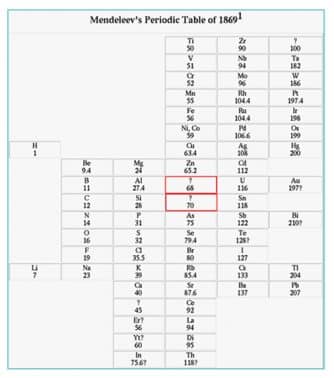
Keunggulan Sistem Periodik Mendeleev :
- Sistem Periodik Mendeleev menyediakan beberapa tempat kosong untuk unsur- unsur yang belum ditemukan. Sifat unsur-unsur tersebut dapat diramalkan berdasarkan kemiripan sifat unsur- unsur dalam golongan yang sama.
- Sistem Periodik Mendeleev meramalkan sifat-sifat unsur yang belum diketahui. Pada perkembangan selanjutnya, beberapa unsur yang ditemukan ternyata cocok dengan prediksi Mendeleev.
Contoh prediksi unsur Germanium oleh Mendeleev:
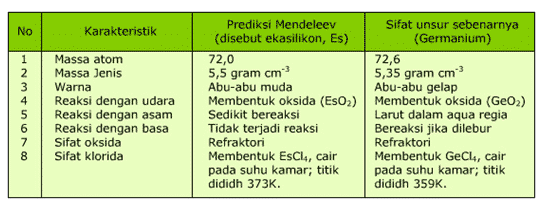
- Sistem Periodik Mendeleev menyediakan satu kolom yang kosong pada group VIII. Kolom ini yang pada perkembangannya berisi unsur-unsur gas mulia. Unsur-unsur ini sangat tidak reaktif, dalam bentuk gas yang tidak berwarna dan tidak berbau dan dalam jumlah yang sangat sedikit di atmosfir. Karena unsur ini tidak dikenal senyawanya,maka para ilmuan di masa Mendeleev tidak tahu adanya unsur ini.Lihat Sistem Periodik Mendeleev

Kelemahan Sistem Periodik Mendeleev :
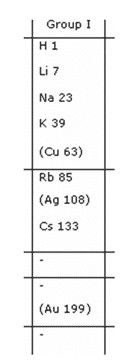
- Adanya unsur-unsur yang tidak mempunyai kesamaan sifat dimasukkan dalam satu golongan, misalnya Cu dan Ag ditempatkan dengan unsur Li, Na, K, Rb dan Cs.
- Adanya penempatan unsur-unsur yang tidak sesuai dengan kenaikan massa atom. Sebagai contoh, unsur Iodin (I-127) mempunyai massa atom yang lebih kecil dibandingkan unsur Telurium (Te-128). Namun dari sifatnya, Mendeleev terpaksa harus mendahulukan unsur Telurium dulu baru unsur Iodin.
- Kelemahan ini menyadarkan para ilmuan bahwa massa atom tidak menentukan sekali dimana suatu unsur empatkan dalam sistem periodik. Kemudian muncullah Sistem periodik Modern yang disusun berdasarkan kenaikan nomor atom. Nomor atom unsur Te (Z=52) yang ternyata lebih kecil dari iodin yaitu (Z=53).
H. Henry Moseley (1913)
Setelah Rutherford menemukan muatan positif dalam inti atom, pada tahun 1913 ilmuan Henry Moseley menemukan nomor atom suatu unsur dengan bantuan sinar X. dari hasil penelitiannya tersebut ia menemukan bahwa kenaikan nomor atom sejalan dengan kenaikan massa atom. Atas dasar penemuan tersebut Henry Moseley menyusun tabel Periodik Berdasarkan kenaikan nomor atom.








0 Comments:
Posting Komentar